OMEGA PERU BLOG
2 de febrero de 2021
Introducción a la filtración de flujo tangencial, método rápido y eficaz para la separación y purificación de biomoléculas, para aplicaciones de desarrollo de procesos y laboratorio
Filtración de flujo tangencial (TFF) es un método rápido y eficaz para la separación y purificación de biomoléculas. Se puede aplicar a una amplia gama de campos biológicos como la inmunología, química de proteínas, biología molecular, bioquímica y microbiología. El TFF se puede utilizar para concentrar y desalar soluciones de muestra que varían en volumen desde 10 ml hasta miles de litros. Se puede utilizar para fraccionar biomoléculas grandes de pequeñas, recolectar suspensiones celulares y clarificar caldos de fermentación y lisados celulares. En este artículo se describe los principios básicos que rigen la TFF y el uso de cápsulas y casetes de TFF en aplicaciones de desarrollo de procesos y de laboratorio.
¿Por qué utilizar la filtración de flujo tangencial?
1. TFF es fácil de configurar y usar – Simplemente conecte el dispositivo TFF a una bomba y manómetros con tubería y accesorios, agregue su muestra al depósito y estará listo para comenzar. En la Figura 1 se muestra un ejemplo de configuración.
2. TFF es rápido y eficiente – Es más fácil de configurar y mucho más rápido que la diálisis. Puede lograr concentraciones más altas en menos tiempo que con dispositivos centrífugos o células agitadas.
3. Realice dos pasos con un sistema – Puede concentrar y diafiltrar una muestra en el mismo sistema, ahorrando tiempo y evitando pérdidas de producto.
4. TFF puede ampliarse o reducirse – Los materiales de construcción y la longitud de la trayectoria del casete permiten que las condiciones establecidas durante las pruebas a escala piloto se apliquen a aplicaciones a escala de proceso. Hay dispositivos TFF disponibles que pueden procesar volúmenes de muestra tan pequeños como 10 ml o tan grandes como miles de litros.
5. TFF es económico – Los dispositivos y casetes de TFF se pueden limpiar y reutilizar, o desechar después de un solo uso. Se puede realizar una prueba de integridad simple para confirmar que la membrana y los sellos están intactos.
¿Qué puede hacer la filtración de flujo tangencial?
1. Concentrar y desalar proteínas y péptidos.
2. Concentrar y desalar los ácidos nucleicos
[ADN / ARN / oligonucleótidos]
.
3. Recuperar y purificar anticuerpos o proteínas recombinantes de medios de cultivo celular.
4. Recuperar y purificar el ADN plasmídico de los lisados celulares o ADN cromosómico de sangre completa.
5. Mezclas de proteínas diluidas fraccionadas
6. Clarificar lisados celulares u homogeneizados de tejidos.
7. Despirogenar (eliminar endotoxinas de) agua, tampones y soluciones de medios.
8. Prepare las muestras antes de la cromatografía en columna.
9. Cosecha de células
10. Recuperar o eliminar virus

El sistema Minimate TFF incluye todo el hardware, los tubos y los accesorios necesarios para que su proceso TFF esté listo y funcionando rápidamente. Simplemente conecte la cápsula Minimate TFF para una concentración o diafiltración eficiente de su muestra.

Descripción general de la filtración de flujo tangencial
¿Qué es la filtración de flujo tangencial?
La filtración por membrana es una técnica de separación muy utilizada en el laboratorio de ciencias biológicas. Dependiendo de la porosidad de la membrana, se puede clasificar como un proceso de microfiltración o ultrafiltración. Las membranas de microfiltración, con tamaños de poro típicamente entre 0,1 µm y 10 µm, se utilizan generalmente para clarificación, esterilización y eliminación de micropartículas o para recolección de células. Las membranas de ultrafiltración, con tamaños de poros mucho más pequeños entre 0,001 y 0,1 µm, se utilizan para concentrar y desalar moléculas disueltas (proteínas, péptidos, ácidos nucleicos, carbohidratos y otras biomoléculas), intercambiar tampones y fraccionamiento bruto. Las membranas de ultrafiltración se clasifican típicamente por corte de peso molecular (MWCO) más que por tamaño de poro.
Hay dos modos de filtración de membrana principal que pueden usar membranas de microfiltración o ultrafiltración:
1) La filtración de flujo directo (DFF), también conocida como filtración “sin salida”, aplica la corriente de alimentación perpendicular a la cara de la membrana e intenta pasar el 100% del fluido a través de la membrana, y
2) Filtración de flujo tangencial (TFF), también conocida como filtración de flujo cruzado, donde la corriente de alimentación pasa paralela a la cara de la membrana cuando una porción pasa a través de la membrana (permeado) mientras que el resto (retenido) se recircula de nuevo al depósito de alimentación.
Se puede ver una analogía para comprender la teoría detrás de TFF al tratar de separar la arena de los alverjas utilizando una pantalla de cribado. Los agujeros en la pantalla representan los poros de la membrana, mientras que la arena y los alverjas representan las moléculas a separar. En DFF, la mezcla de arena y alverjas se fuerza hacia los orificios de la pantalla. Los granos de arena más pequeños caen a través de los poros de la pantalla, pero las alverjas más grandes forman una capa en la superficie de la pantalla. Esto evita que los granos de arena en la parte superior de la mezcla se muevan hacia y a través de los orificios (Figura 2A). Con DFF, aumentar la presión simplemente comprime la mezcla sin aumentar la separación. Por el contrario, operar en un modo TFF evita la formación de una capa restrictiva al recircular la mezcla. El proceso actúa como un tamiz que agita para quitar los alverjas que bloquean los agujeros en la malla, permitiendo que los granos de arena en la parte superior de la mezcla caigan hacia y a través de los agujeros en la malla (Figura 2B).
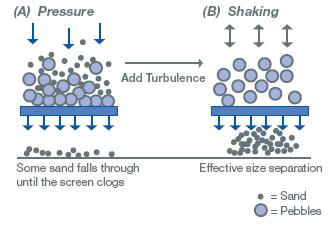
Figura 2 : Separación de arena y alverjas mediante una criba
(A) La aplicación de presión directa a la mezcla permite que los granos de arena del fondo caigan. Una capa de alverjas se acumula en la superficie de la pantalla, lo que evita que los granos de arena en la parte superior se muevan hacia y a través de la pantalla.
(B) Agitar la pantalla rompe la capa de alverjas agregadas en la parte inferior de la mezcla y permite el fraccionamiento completo. La dinámica de flujo cruzado de la corriente de alimentación en la filtración de flujo tangencial tiene el mismo propósito que la agitación en este ejemplo.
En solución, se encuentra el mismo efecto para DFF (Figura 3) y para TFF (Figura 4). El flujo de la solución de muestra a través de la superficie de la membrana barre las moléculas agregadas que forman un gel que obstruye la membrana (polarización del gel), lo que permite que las moléculas más pequeñas que los poros de la membrana se muevan hacia y a través de la membrana. Por lo tanto, TFF puede ser más rápido y más eficiente que DFF para la separación de tamaños.
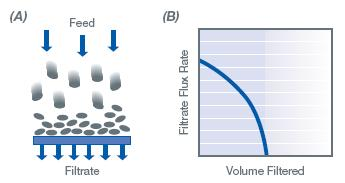
Figura 3 : Proceso de filtración de flujo directo
(A) La alimentación se dirige hacia la membrana. Las moléculas más grandes que los poros se acumulan en la superficie de la membrana para formar un gel, que ensucia la superficie y bloquea el flujo de líquido a través de la membrana.
(B) A medida que aumenta el volumen filtrado, aumenta el ensuciamiento y la tasa de flujo disminuye rápidamente.
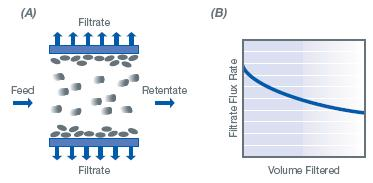
Figura 4 : Proceso de filtración de flujo tangencial
(A) La solución de muestra fluye a través del canal de alimentación y a lo largo (tangente a) la superficie de la membrana, así como a través de la membrana. El flujo cruzado evita la acumulación de moléculas en la superficie que puede causar suciedad.
(B) El proceso TFF evita la rápida disminución en la tasa de flujo que se observa en la filtración de flujo directo, lo que permite procesar un mayor volumen por unidad de área de superficie de la membrana.
Aplicaciones
Las principales aplicaciones de la TFF son la concentración, la diafiltración (desalación e intercambio de tampón) y el fraccionamiento de biomoléculas grandes y pequeñas. Además, se puede utilizar para clarificar y eliminar células, así como residuos celulares de caldos de fermentación o cultivo celular.
Concentración
La concentración es un proceso simple que implica eliminar el líquido de una solución mientras retiene las moléculas de soluto. La concentración del soluto aumenta en proporción directa a la disminución del volumen de la solución, es decir, al reducir a la mitad el volumen se duplica efectivamente la concentración.
Para concentrar una muestra, elija una membrana de UF con un MWCO que sea sustancialmente menor que el peso molecular de las moléculas a retener. Esto es importante para asegurar una retención completa y una alta recuperación de la molécula diana. Una buena regla general es seleccionar una membrana con un MWCO que sea de 3 a 6 veces menor que el peso molecular de las moléculas a retener. Por ejemplo, si la tasa de flujo (o el tiempo de procesamiento) es una consideración importante, la selección de una membrana con un MWCO hacia el extremo inferior de este rango (3x) producirá tasas de flujo más altas. Si la recuperación es la preocupación principal, la selección de una membrana más ajustada (6x) producirá una recuperación máxima (con un caudal más lento).
Se instala la membrana (o se selecciona una cápsula de TFF desechable) y se inicializa el sistema de TFF (generalmente se enjuaga con agua y se prueba la tasa de flujo del filtrado de agua y la integridad). Se agrega la muestra, se establece un flujo cruzado, se establecen las presiones de alimentación y retenido, luego se recoge el filtrado. Cuando se alcanza la concentración deseada, el proceso se detiene y puede comenzar la recuperación de la muestra o la diafiltración.
Diafiltración
La diafiltración es el proceso de fraccionamiento que lava las moléculas más pequeñas a través de una membrana y deja moléculas más grandes en el retenido sin cambiar finalmente la concentración. Puede usarse para eliminar sales o intercambiar tampones. Puede eliminar etanol u otros pequeños disolventes o aditivos.
Hay varias formas de realizar la diafiltración. En la diafiltración continua, la solución de diafiltración (agua o tampón) se agrega al depósito de alimentación de muestra a la misma velocidad a la que se genera el filtrado. De esta manera, el volumen en el depósito de muestra permanece constante, pero las moléculas pequeñas (por ejemplo, sales) que pueden penetrar libremente a través de la membrana se eliminan por lavado. Utilizando la eliminación de sal como ejemplo, cada volumen de diafiltración (DV) adicional reduce aún más la concentración de sal. (Un volumen de diafiltración es el volumen de muestra antes de agregar la solución de diafiltración). El uso de 5 volúmenes de diafiltración reducirá la fuerza iónica en ~ 99% con diafiltración continua.
En la diafiltración discontinua, la solución se diluye primero y luego se concentra de nuevo al volumen inicial. Este proceso se repite luego hasta que se alcanza la concentración requerida de moléculas pequeñas (por ejemplo, sales) que quedan en el depósito. Cada volumen de diafiltración adicional (DV) reduce aún más la concentración de sal. Un volumen de diafiltración es el volumen de muestra antes de agregar la solución de dilución. El uso de 5 volúmenes de diafiltración reducirá la fuerza iónica en ~ 96% con diafiltración discontinua.
La diafiltración continua requiere menos volumen de filtrado para lograr el mismo grado de reducción de sal que la diafiltración discontinua
Variables de proceso en la filtración de flujo tangencial
Dos de las variables importantes involucradas en todos los dispositivos de flujo tangencial son la presión transmembrana (TMP) y la velocidad de flujo cruzado (CF).
1. La presión transmembrana es la fuerza que impulsa el fluido a través de la membrana, transportando las moléculas permeables.
2. La velocidad de flujo transversal es la tasa de flujo de la solución a través del canal de alimentación y a través de la membrana. Proporciona la fuerza que barre las moléculas que pueden ensuciar la membrana y restringir el flujo de filtrado.
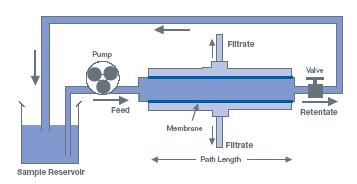
Figura 5 : Ruta de flujo a través de un dispositivo TFF simple
El fluido se bombea desde el depósito de muestra al puerto de alimentación, a través de la superficie de la membrana (flujo cruzado), sale por el puerto de retenido y vuelve al depósito de muestra (Figura 5). El flujo cruzado barre las moléculas más grandes y los agregados que quedan retenidos en la superficie de la membrana, evitando la polarización del gel (la formación de una capa de biomolécula concentrada en la superficie de la membrana que puede ensuciar o tapar la membrana). El líquido que fluye a través del canal de alimentación estrecho crea una caída de presión entre los puertos de alimentación y retenido. Esta presión, que se aplica a la membrana, se puede incrementar aún más aumentando la tasa de flujo cruzado o restringiendo el tubo en el puerto del retenido. Esta presión transmembrana (TMP) es la fuerza que impulsa el líquido a través de la membrana.
El líquido que fluye a través de la membrana (filtrado o permeado) transporta moléculas más pequeñas que los poros de la membrana a través del filtro. El truco para usar TFF de manera efectiva es regular tanto la TMP como la tasa de flujo cruzado para evitar el ensuciamiento de la membrana, lo que permite procesar un mayor volumen de producto en el menor tiempo posible.
Conjunto de dispositivo de flujo tangencial
Los sistemas de filtración de flujo tangencial generalmente requieren un dispositivo TFF (cápsula, casete y soporte, módulo de fibra hueca, etc.) con una bomba (peristáltica o equivalente), tubería, válvulas o abrazaderas, uno o más manómetros y un depósito de muestra (Figura 1, 6). Los manómetros se instalan típicamente en los puertos de alimentación, retenido y filtrado en los sistemas de desarrollo y proceso de TFF.
Si bien es posible operar un sistema TFF sin manómetros, se recomienda encarecidamente el uso de al menos un manómetro en el lado de alimentación (entre la bomba y la unidad TFF). La presión es una variable importante en el proceso de TFF.
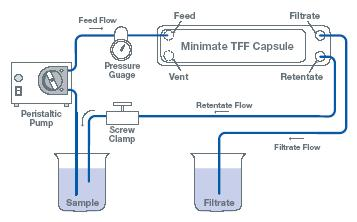
Figura 6 : Diagrama de un sistema de cápsula Minimate TFF con bomba, manómetro, abrazadera de tornillo de retención, depósitos y conexiones de tubería
El funcionamiento de un sistema TFF consta de los siguientes pasos:
1. Enjuague el dispositivo TFF antes de usarlo para eliminar el agente de almacenamiento.
2. Establezca la permeabilidad al agua normalizada (PNT) de la membrana para establecer una línea de base para el rendimiento del dispositivo. (Este paso no es necesario, pero se recomienda encarecidamente si se va a limpiar y reutilizar el dispositivo).
3. Acondicione el sistema con el tampón de muestra. (El acondicionamiento ayuda a eliminar el aire del sistema, ajustar la temperatura del sistema y evitar la posible precipitación o desnaturalización de biomoléculas que resultan del contacto con la solución de lavado).
4. Procese la muestra (concentración y / o diafiltración o fraccionamiento).
5. Limpiar; determinar la eficacia de la limpieza.
6. Almacene el dispositivo TFF.
Referencias:
Schwartz, L y Seeley, K. (s/a). Introduction to Tangential Flow Filtration for Laboratory and Process Development Applications. Pall Corporation
Conozca más sobre nuestros Equipos y Suministros para Filtración por Flujo Tangencial en la sección de Ciencias de la vida en nuestra web. Para más información, puede comunicarse con nosotros al 336 – 6523 o ventas@omegaperu.com.pe
Suscríbete a la lista de correos de Omega Perú para recibir información de eventos, aplicaciones y los últimos desarrollos tecnológicos.

